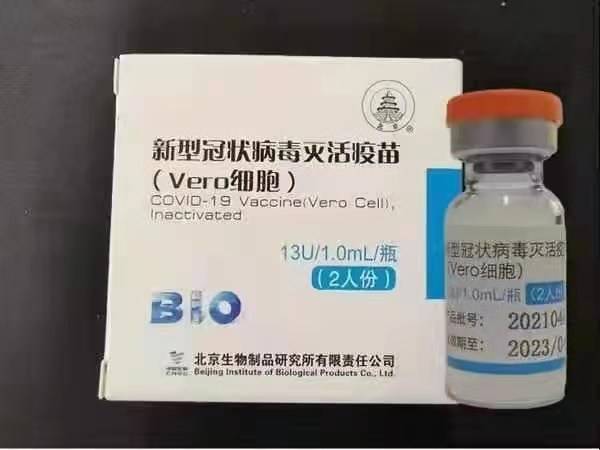
Sinopharm (Peking): BBIBP-CorV
VAIHE 1
1 Kokeilu
ChiCTR2000032459
Kiina
VAIHE 2
2 kokeilua
NCT04962906
Argentiina
ChiCTR2000032459
Kiina
VAIHE 3
6 kokeilua
NCT04984408
ChiCTR2000034780
Yhdistyneet Arabiemiirikunnat
NCT04612972
Peru
NCT04510207
Bahrain, Egypti, Jordania, Yhdistyneet Arabiemiirikunnat
NCT04560881, BIBP2020003AR
Argentiina
NCT04917523
Yhdistyneet Arabiemiirikunnat
Hyväksynnät
WHO: n hätäkäyttöluettelo 59 maata
Angola, Argentiina, Bahrain, Bangladesh, Valko -Venäjä, Belize, Bolivia (monikansallinen valtio), Brasilia, Brunei Darussalam, Kambodža, Kamerun, Tšad, Kiina, Komorit, Egypti, Päiväntasaajan Guinea, Gabon, Gambia, Georgia, Guyana 、 Iran (islamilainen tasavalta) 、 Irak 、 Jordan 、 Kirgisia 、 Laosin kansan demokraattinen tasavalta
Libanon, Malesia, Malediivit, Mauritania, auritius, Mongolia, Montenegro, Marokko, Mosambik, Namibia, Nepal, Niger, Pohjois -Makedonia, Pakistan, Paraguay, Peru, Filippiinit, Kongon tasavalta, Enegal, Lexon Saaret, Somalia, Sri Lanka, Thaimaa, Trinidad ja Tobago, Tunisia, Yhdistyneet arabiemiirikunnat, Venezuela (Bolivarian tasavalta), Vietnam, Zimbabwe
Sinopharm BBIBP-CorV COVID-19 on inaktivoitu rokote, joka on valmistettu viljelmässä kasvatetuista viruspartikkeleista, joilta puuttuu patogeeninen kyky. Tämän rokotekandidaatin ovat kehittäneet Sinopharm Holdings ja Beijing Institute of Biological Products.
Sinopharm BBIBP-CorV -rokote toimii antamalla immuunijärjestelmän tuottaa vasta-aineita SARS-CoV-2-beeta-koronavirusta vastaan. Inaktivoituja virusrokotteita, kuten raivotautirokotetta ja hepatiitti A -rokotetta, on käytetty vuosikymmenien ajan. Tätä kehitystekniikkaa on sovellettu menestyksekkäästi moniin tunnettuihin rokotteisiin, kuten raivotautirokotteeseen.
Sinopharmin SARS-CoV-2-kanta (WIV04-kanta ja kirjaston numero MN996528) eristettiin potilaalta Jinyintanin sairaalassa Wuhanissa, Kiinassa. Virusta lisättiin viljelmässä pätevässä Vero-solulinjassa, ja tartunnan saaneiden solujen supernatantti inaktivoitiin P-propiolaktonilla (1: 4000 tilavuus/tilavuus, 2-8 ° C) 48 tunnin ajan. Solujäännösten selkeyttämisen ja ultrasuodatuksen jälkeen suoritettiin toinen β-propiolaktonin inaktivointi samoissa olosuhteissa kuin ensimmäinen inaktivointi. WHO: n mukaan rokote adsorboitiin 0,5 mg: aan alunaa ja ladattiin esitäytettyihin ruiskuihin 0,5 ml: ssa steriiliä fosfaattipuskuroitua suolaliuosta ilman säilöntäaineita.
Valtion lääkevirasto ilmoitti 31. joulukuuta 2020 Sinopharmin kehittämän kokeellisen rokotteen hyväksymisestä.
Maailman terveysjärjestö ilmoitti rokotteen hyväksymisestä 7. toukokuuta 2021. WHO: n hätäkäyttöluettelo mahdollisti maiden nopeuttaa omia viranomaishyväksyntäänsä tuoda ja antaa COVID-19-rokotetta. Myös WHO: n rokotusstrategioiden neuvoa -antava asiantuntijaryhmä on saanut päätökseen rokotteen tarkastelun. Kaikkien saatavilla olevien todisteiden perusteella WHO suosittelee 18 -vuotiaille ja sitä vanhemmille aikuisille kaksi rokoteannosta kolmen tai neljän viikon välein. Rokotteen tehokkuus oireita ja sairaalahoitoa vastaan arvioidaan 79 prosentiksi kaikissa ikäryhmissä yhteensä.
American Medical Association julkaisi 26. toukokuuta 2021 "Satunnaistetun kliinisen tutkimuksen: Kahden inaktivoidun SARS-CoV-2-rokotteen vaikutus aikuisten oireiseen COVID-19-infektioon", ja päätteli, että "tässä satunnaistetun kliinisen tutkimuksen ennalta määritetyssä välianalyysissä, aikuiset Kaksi inaktivoitua SARS-CoV-2-rokotetta, jotka annettiin tässä ennalta määrätyssä satunnaistettujen kliinisten tutkimusten välianalyysissä, vähensivät merkittävästi oireisen COVID-19-riskin riskiä, ja vakavat haittatapahtumat olivat harvinaisia. " Tässä vaiheen 3 satunnaistetussa tutkimuksessa aikuisilla kahden inaktivoidun kokovirusrokotteen teho oireellisissa COVID-19-tapauksissa oli 72,8% ja 78,1%. Kahdella rokotteella oli harvinaisia vakavia haittatapahtumia, joiden esiintymistiheys oli samankaltainen kuin pelkästään alunan vertailuryhmässä, ja useimmat eivät liittyneet rokotukseen. Tutkimusanalyysi osoitti, että kaksi rokotetta indusoivat mitattavia neutraloivia vasta -aineita, samanlaisia kuin vaiheen 1/2 kokeen tulokset.
WHO SAGE -työryhmä julkaisi katsauksen Sinopharm/BBIBP COVID-19 -rokotteesta 10. toukokuuta 2021. GAVIn COVID-19-rokote sisältää rokotteen injektiopullomonitorin, joka kertoo terveydenhuollon työntekijöille, onko rokote säilytetty oikein eikä sitä ole altistettu. ylikuumeneminen. Tämän seurauksena vauriot, GAVI ilmoitti 14. toukokuuta 2021. . Tämä muuttuu tummemmaksi antaakseen visuaalisen osoitteen kumulatiivisesta lämpöaltistuksesta. Kun injektiopullo on altistettu kuumuudelle, joka ylittää optimaalisen säilytysalueen, neliö muuttuu ympyrää tummemmaksi, mikä osoittaa, että rokotetta ei pitäisi enää käyttää.
Kansallinen huumeiden BBIBP-CorV COVID-19 -rokotteen lääkekirjaston rekisteröintinumero: DB15807.